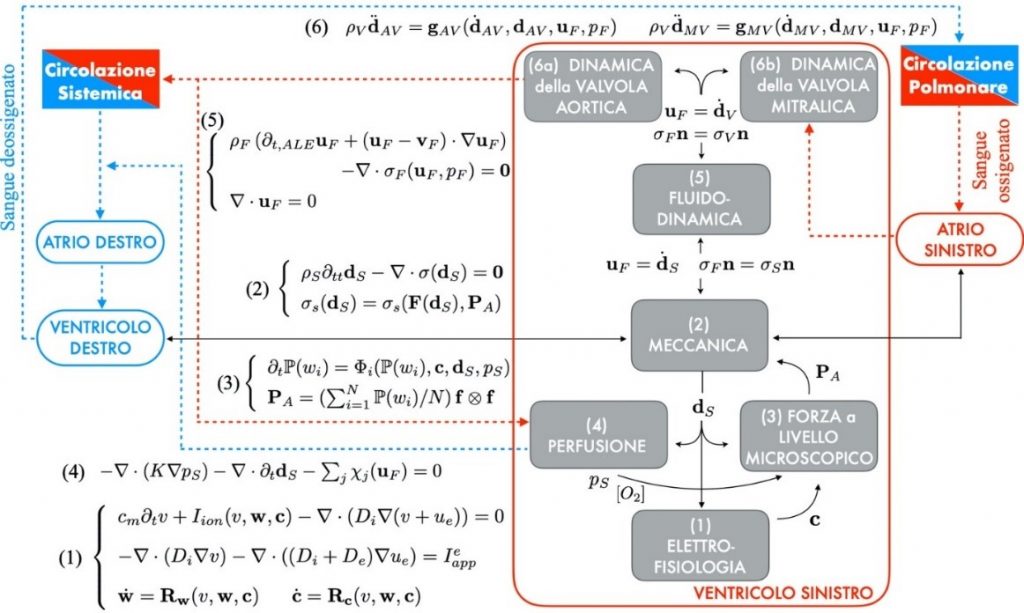
Giunto al suo terzo anno il Progetto “iHEART” si pone l’ambizioso obiettivo di realizzare un modello matematico completo per lo studio del comportamento del cuore umano e delle sue patologie, una sorta di “microscopio virtuale”, in cui siano integrati tutti i processi della funzione cardiaca: la propagazione dell’impulso elettrico, l’attivazione cellulare, la
contrazione e il rilassamento del miocardio durante le fasi sistolica e diastolica, la fluidodinamica nel sangue nei ventricoli e negli atrii, la dinamica di apertura e chiusura delle quattro valvole cardiache.
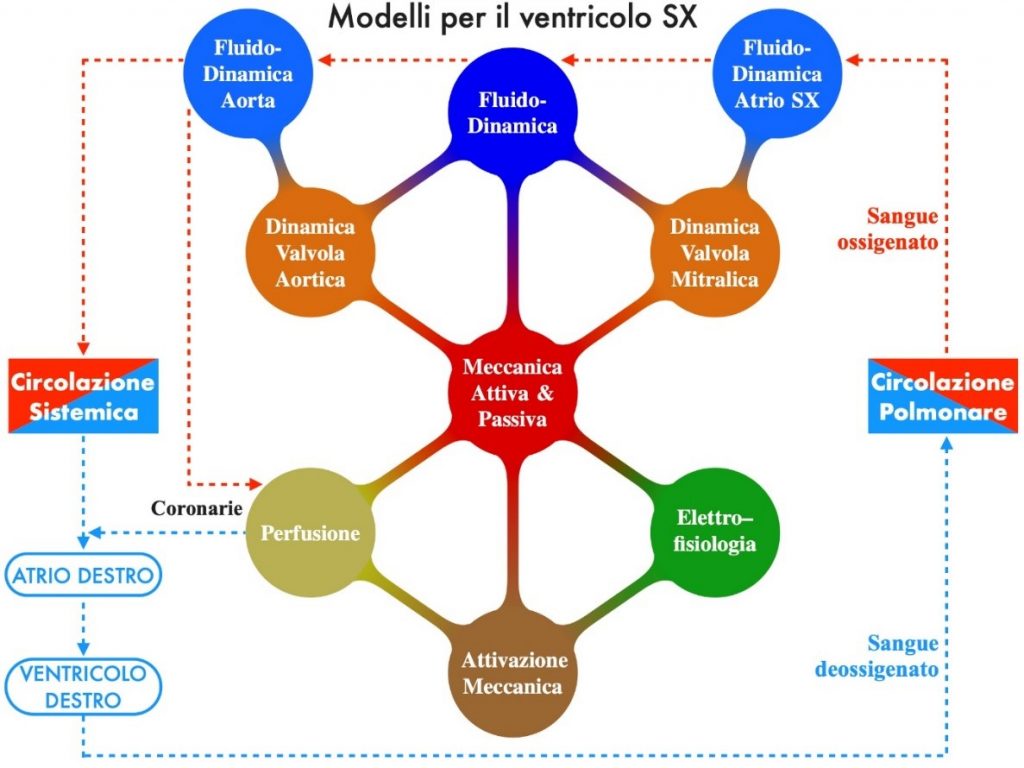
Le ricerche sviluppate finora hanno già permesso di rendere operativi alcuni moduli che stanno suscitando un grande interesse nella comunità medica; dagli studi di fattibilità si è quindi passati alle prime prove sul campo, in cui matematici e medici lavorano fianco a fianco nella ottimizzazione di questi nuovi strumenti all’interno di delicate procedure di
intervento per far fronte ad alcune patologie cardiache di grande rilevanza.
Ecco alcuni esempi.
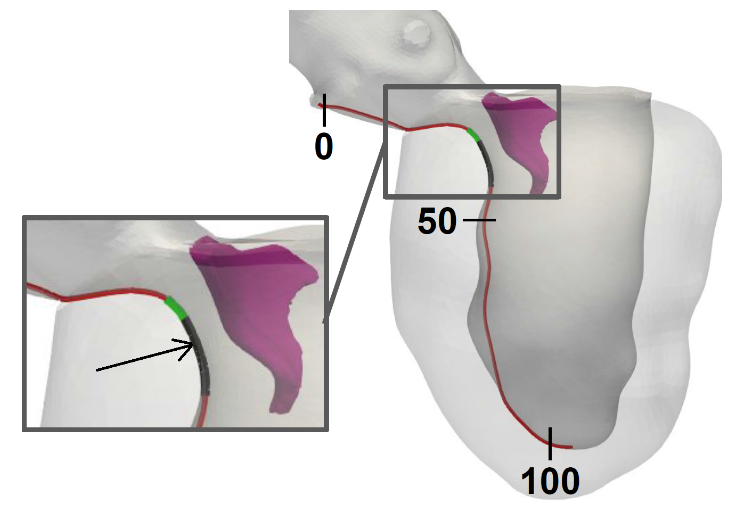
Grazie ai modelli matematici sviluppati in iHEART, è stato possibile produrre indicazioni quantitative sui fattori che favoriscono l’innesco e il mantenimento di aritmie, come la tachicardia ventricolare. Le tradizionali modalità di intervento consistono nell’effettuare ablazioni trans-catetere, che permettono, tramite l’erogazione di radiofrequenza, di rendere inattive le aree anomale che causano l’aritmia 1 . In collaborazione con l’unità di aritmologia ed elettrofisiologia cardiaca dell’IRCCS Ospedale San Raffaele di Milano, si è verificato come la matematica cardiaca riesca a supportare e a consolidare lo studio elettrofisiologico nella localizzazione delle zone di intervento sulla parete del cuore.
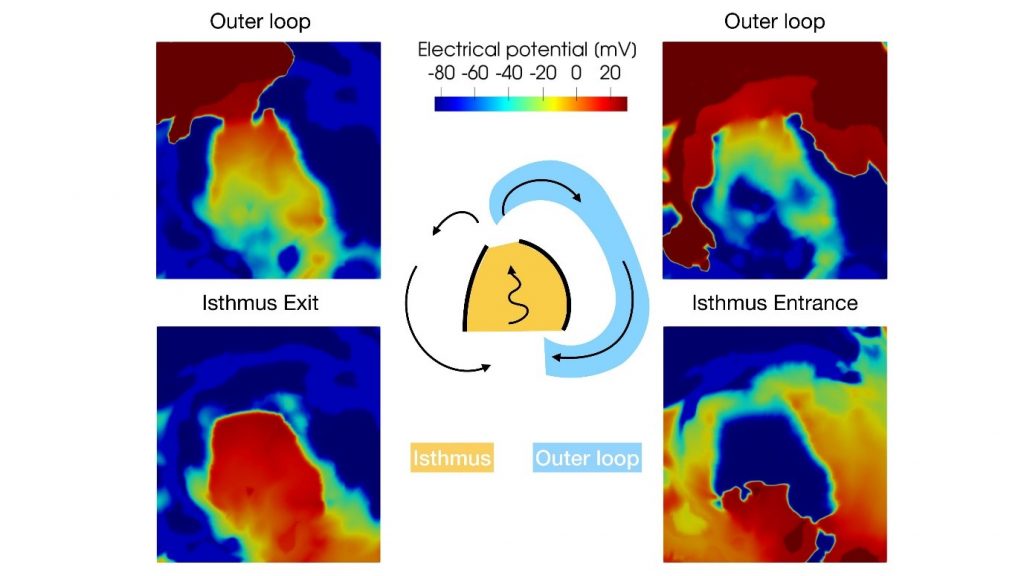
(Credit: S. Pagani, iHEART – Politecnico di Milano)
Sono inoltre in avanzata fase di sviluppo algoritmi sempre più rapidi, che consentiranno di effettuare questo tipo di analisi in tempo reale, velocizzando in maniera significativa il processo decisionale dell’intervento.
In collaborazione con l’Ospedale Sacco di Milano viene attualmente sviluppato un modello che fornisce indicazioni precise al cardiochirurgo su come effettuare la miectomia (rimozione) di una porzione del setto interventricolare, mediante un’analisi non invasiva e a bassissimo costo.
Questo trattamento è il più usato per curare la cardiomiopatia ipertrofica ostruttiva, che consiste nell’ispessimento del setto a tal punto da rendere difficoltosa l’espulsione del sangue dal ventricolo sinistro nell’aorta ascendente.
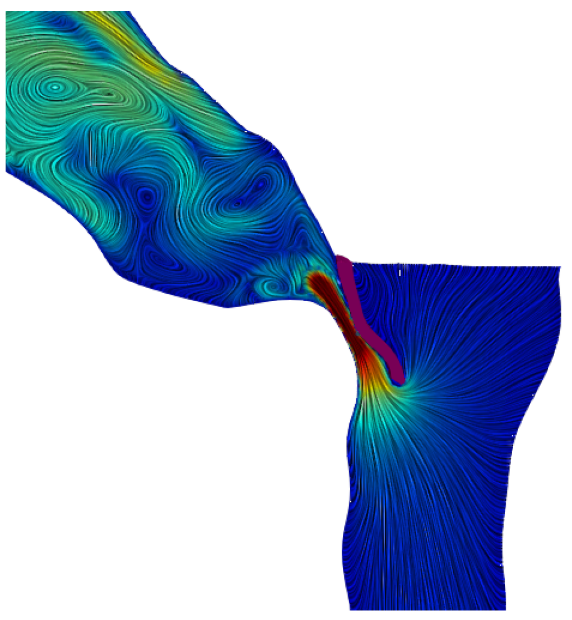
Regione ottimale per la miectomia (in grigio scuro)
(Credit: I.Fumagalli, iHEART – Politecnico di Milano)
La simulazione matematica si inserisce nella fase pre-operatoria, ed è stata considerata dai medici come efficace strumento di guida per il delicato intervento.
Un ulteriore strumento computazionale è stato sviluppato in collaborazione con la cardiologia e radiologia dell’Ospedale S. Maria del Carmine di Rovereto (TN), riguardo all’ottimizzazione della terapia di risincronizzazione cardiaca (CRT) che consiste nell’impianto di un device in grado di ripristinare la corretta sincronia del battito cardiaco compromessa da disturbi di conduzione o dalla presenza di cicatrici. A tal fine i cardiologi
devono effettuare un mappaggio del ventricolo sinistro per rilevarne l’attività elettrica, che consiste nell’inserimento di un catetere-elettrodo attraverso i vasi della circolazione. Lo strumento matematico, attualmente validato, permetterà di ridurre considerevolmente il tempo di mappaggio e quindi i tempi di esposizione del paziente ad un trattamento invasivo,
e di guidare il posizionamento del catetere nel posto più curativo per il paziente scompensato.
Come questi esempi dimostrano, iHEART ha aperto nuovi orizzonti fra matematica e medicina traslazionale e ha istituito un’azione coordinata e sistematica fra Università e ospedali creando una nuova figura professionale all’interfaccia fra matematica, bioingegneria, medicina e data science. “…. Grazie a tutte le nuove collaborazioni cliniche e all’attività integrata dei nostri giovani ricercatori (dottorandi e post doc) con quella dei ricercatori operanti presso strutture ospedaliere, riteniamo di riuscire a tracciare una pista importante in Italia in una disciplina nuova, la Medicina Computazionale”, riassume il Prof. Quarteroni.